«Сухая» батарейка на основе элемента Лекланше
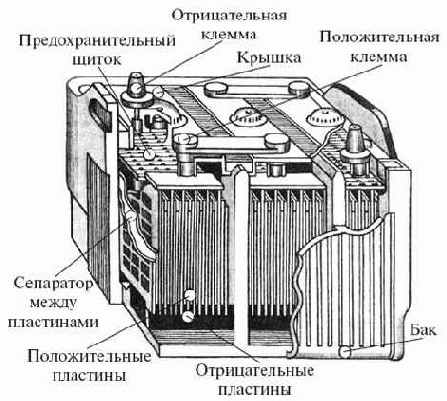
Лекланше, твердые – цинковый стаканчик и графитовый стержень. А вот электролит уже не жидкий. Ведь жидкость может в любой момент пролиться, а делать элемент герметичным дорого и сложно. Вот и заменили жидкость желеобразным электролитом. Получился удобный и практичный источник электричества. Если через разряженную сухую батарею особыми импульсами пропустить ток, ее можно вновь «оживить». Эту операцию порой проделывают по несколько раз. Однако она ненадолго восстанавливает элемент. Постойте-постойте… Как бы там ни было, получается, что гальванический элемент – тот же аккумулятор! Заряжая его электрическим током, восстанавливая, мы накапливаем в нем электроэнергию, которую затем расходуем. Так ли это? Оказывается, и так и не так. Прежде всего, не каждый гальванический элемент можно подзарядить. Нельзя это сделать, например с элементом, который состоит из двух электролитов. Таков элемент Даниэля, где две разные жидкости разделены пористым стаканчиком. Постепенно просачиваясь через стаканчик, электролиты смешиваются, реагируют друг с другом и выделяют ток. Этот элемент, если он уже отработал свой срок, не восстановишь. Другие элементы с твердыми электродами в принципе подзаряжаются, накапливают энергию. Но процесс накопления столь неэкономичен и неэффективен, что многие считают подзарядку таких элементов неоправданной. Накапливается только ничтожная часть поданной на элемент электроэнергии, а сам элемент после нескольких таких зарядок разрушается. Чтобы стать хорошим накопителем, гальванический элемент должен достаточно хорошо «переносить» процесс зарядки. И этого наконец удалось добиться в середине XIX века. В 1859 году французский ученый и инженер Гастон Планте провел любопытный опыт, внешне очень похожий на опыт Вольты. Как и Вольта, Планте построил гальванический элемент, однако в качестве электродов он взял две свинцовые пластины, в обычных условиях покрытые пленкой окиси свинца. Электролит был все тот же – разбавленная серная кислота. Планте подключил к электродам источник постоянного тока и некоторое время пропускал ток через свой элемент, совсем как при подзарядке сухих элементов.
Потом он отключил ток и подключил к электродам гальванометр. Прибор показал, что гальванический элемент сам стал вырабатывать электроток и при этом выделять почти всю энергию, затраченную на его зарядку. Зарядку можно было повторять много раз: элемент неизменно работал исправно и не разрушался, подобно сухим батареям. Этот гальванический элемент назвали элементом второго рода, или аккумулятором. Как же происходит накопление энергии в аккумуляторе Планте? При пропускании тока через электролит из серной кислоты на свинцовой пластине, соединенной с отрицательным полюсом источника тока – катодом,– выделяется водород, который восстанавливает окись свинца в чистый свинец. На электроде, соединенном с положительным полюсом – анодом, – выделяется кислород, который окисляет окись свинца до перекиси. Аккумулятор зарядится в тот момент, когда катод целиком станет чистым свинцом, а анод – перекисью свинца. Тогда между электродами окажется наибольшее напряжение. Соединяя пластины-электроды проводником с потребителем, расходуя энергию, мы разряжаем аккумулятор. Направление тока при разрядке противоположно тому, что было при зарядке. Положительно заряженная пластина будет восстанавливаться водородом, а отрицательная – окисляться кислородом. Как только пластины станут одинаковыми, аккумулятор прекратит давать ток. Надо повторить зарядку. Ясно, что энергия в таком аккумуляторе накапливается не в виде электрического или магнитного поля, как в предыдущих накопителях электрической энергии, а в виде вполне осязаемого вещества – свинца, переходящего с выделением энергии в перекись свинца. Сам процесс накопления и выделения энергии здесь происходит иначе, нежели в чисто электрических аккумуляторах – конденсаторах и электромагнитах. Поэтому такой аккумулятор принято называть электрохимическим.